小鼠模型实验丨厦门大学吴乔陈航姿黄巧玲团队揭示肝星状细胞通过胞外囊泡外泌己糖激酶HK1加速肝癌进程的机制
2022年10月3日,厦门大学吴乔教授团队在Nature Metabolism在线发表了题为“HK1 from hepatic stellate cell–derived extracellular vesicles promotes progression of hepatocellular carcinoma”的文章。该研究使用来自集萃药康的Hk1f/f(品系编号:T052189)和Lrat-P2A-iCre(品系编号:T006205)小鼠模型进行研究,结合免疫荧光技术、GST pull-down实验、蛋白质组学分析等多个技术手段,揭示了肝星状细胞中HK1通过胞外囊泡释放后能够加速肝癌进程的机制。同时筛选到一种抑制HCC进展的化合物PDNPA,为HCC的治疗提供一种新策略。

正文文
1、TGF-β促纤维化过程中诱导HSCs分泌lEV HK1
为了研究纤维化过程中细胞间交流,研究者在LX-2肝星状细胞中分别提取了胞外大囊泡和胞外小囊泡,进行蛋白质组学分析。通过GO富集分析发现HK1是TGF-β刺激后胞外大囊泡中最为富集的蛋白之一。TGF-β能够促进小鼠肝星状细胞通过胞外大囊泡分泌HK1。研究者利用四氯化碳(CCl4)诱导的肝纤维化小鼠模型https://www.gempharmatech.com/produce/model/3.html进行研究,发现纤维化伴随着胞外大囊泡外泌HK1。共聚焦结果显示,TGF-β处理促进了HK1从线粒体向质膜的转移。此外,过量表达TSG101显著增加了胞外大囊泡中HK1的分泌。表明HK1是通过胞外大囊泡从肝星状细胞特异性分泌的,TGF-β诱导线粒体HK1运输到质膜,而TSG101进一步协助HK1通过胞外大囊泡分泌。
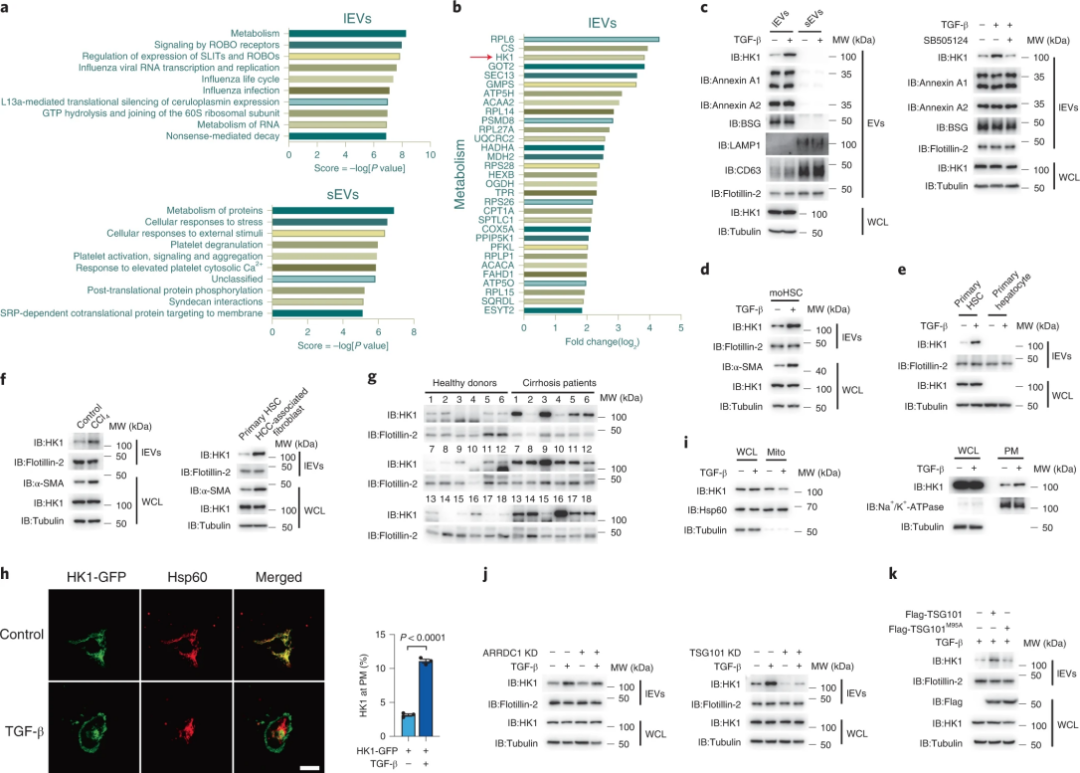
图1.TGF-β诱导肝纤维化中lEV HK1的分泌
2、HK1的棕榈酰化促进了HK1靶向质膜的分泌
研究者发现用去棕榈酰化酶抑制剂棕榈抑素B(PalmB)或TGF-β处理能够显著增强HK1棕榈酰化程度,而用棕榈酰化抑制剂2-溴棕榈酸酯(2-BP)处理,则去除了HK1的棕榈酰化。此外,即使用TGF-β处理,HK1在质膜上的定位仍会被2-BP阻断,而当没有TGF-β处理时,会被PalmB增强。表明TGF-β诱导的棕榈酰化有利于HK1从线粒体转移到质膜,然后通过胞外大囊泡分泌。敲除去棕榈酰化酶ABHD17B能够明显增强HK1的棕榈酰化和分泌,并且影响了TGF-β对HK1的诱导。因此,在肝纤维化过程中,TGF-β通过抑制ABHD17B依赖的HK1的去棕榈酰化来促进HK1的分泌。
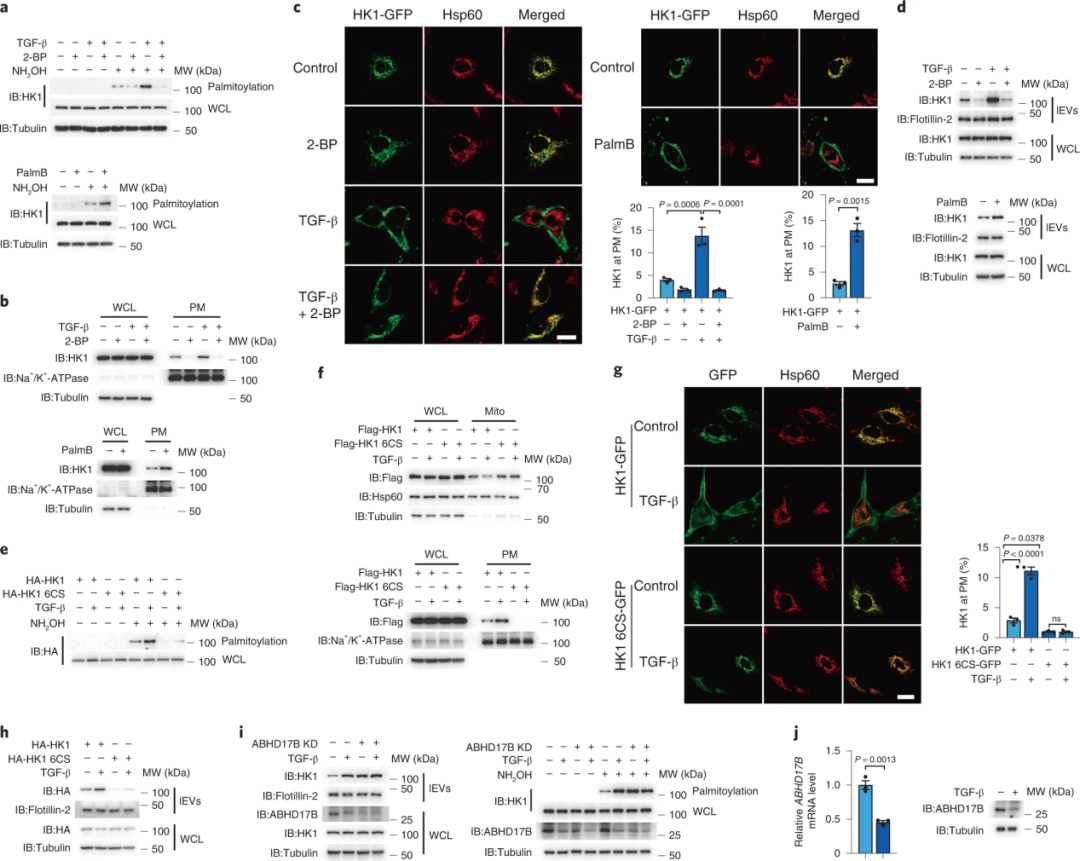
图2.TGF-β诱导HK1棕榈酰化并向质膜运输
3、HCC细胞劫持来源于肝星状细胞的lEV HK1以加速糖酵解过程
研究者对CCLE进行分析发现,肝癌细胞表达的HK1水平相对较低。此外,通过共聚焦观察及对肝癌相关模型进行实验发现,HCC细胞中的HK1蛋白可能不是自身表达的,而是来源于对肝星状细胞分泌的lEV HK1的摄取。鉴于HK1在糖酵解中的重要作用,作者研究发现Huh7和HepG2细胞葡萄糖吸收和胞外酸化率(ECAR)明显升高的现象在HK1敲除的情况下没有发生。当重新表达HK1时,可以提高Huh7和HepG2细胞葡萄糖摄取量、ECAR的能力以及细胞增殖情况。此外,用糖酵解抑制剂处理Huh7和HepG2细胞时,lEVs不再促进细胞增殖。表明肝星状细胞释放的HK1通过糖酵解重编程促进HCC细胞的增殖。
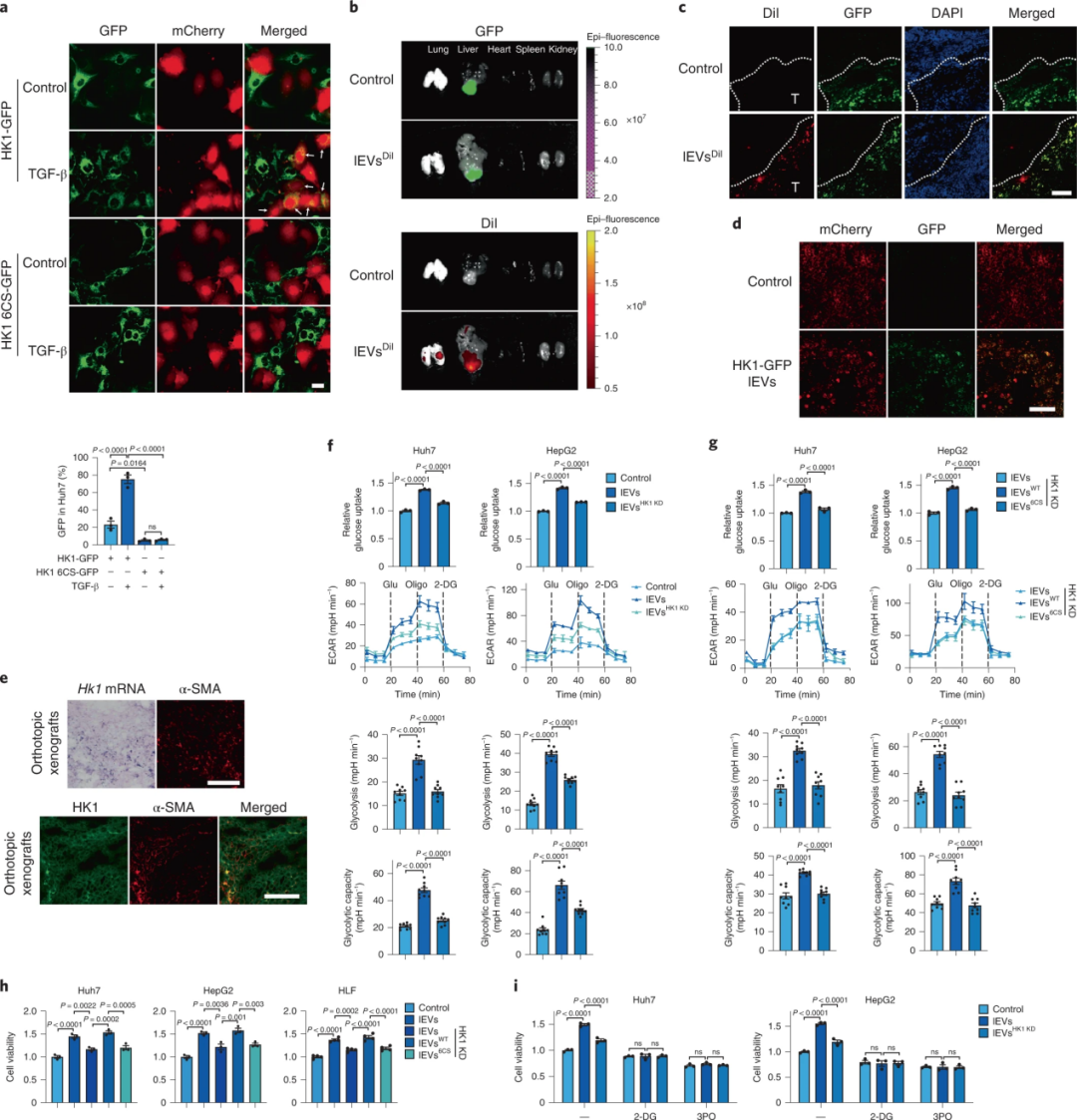
图3.HCC细胞劫持来源于肝星状细胞的lEV HK1以促进糖酵解
4、HSC衍生的lEV HK1促进小鼠模型中的HCC进展
为了进一步探索lEV HK1与HCC之间的关系,作者对小鼠肝癌模型进行研究,发现lEV HK1显著促进肿瘤生长,并且伴随着Ki67的蛋白水平升高。通过对Hk1f/f与Gfap-Cre的小鼠进行杂交,得到在肝星状细胞中特异性敲除Hk1的小鼠(Hk1f/f;Gfap-Cre),其肿瘤生长及HK1和Ki67表达受到抑制。此外,研究者发现肝星状细胞来源的HK1能明显促进肝癌的肺部转移,且转移组织中的HK1表达升高,表明lEV HK1能够促进肿瘤的进展。
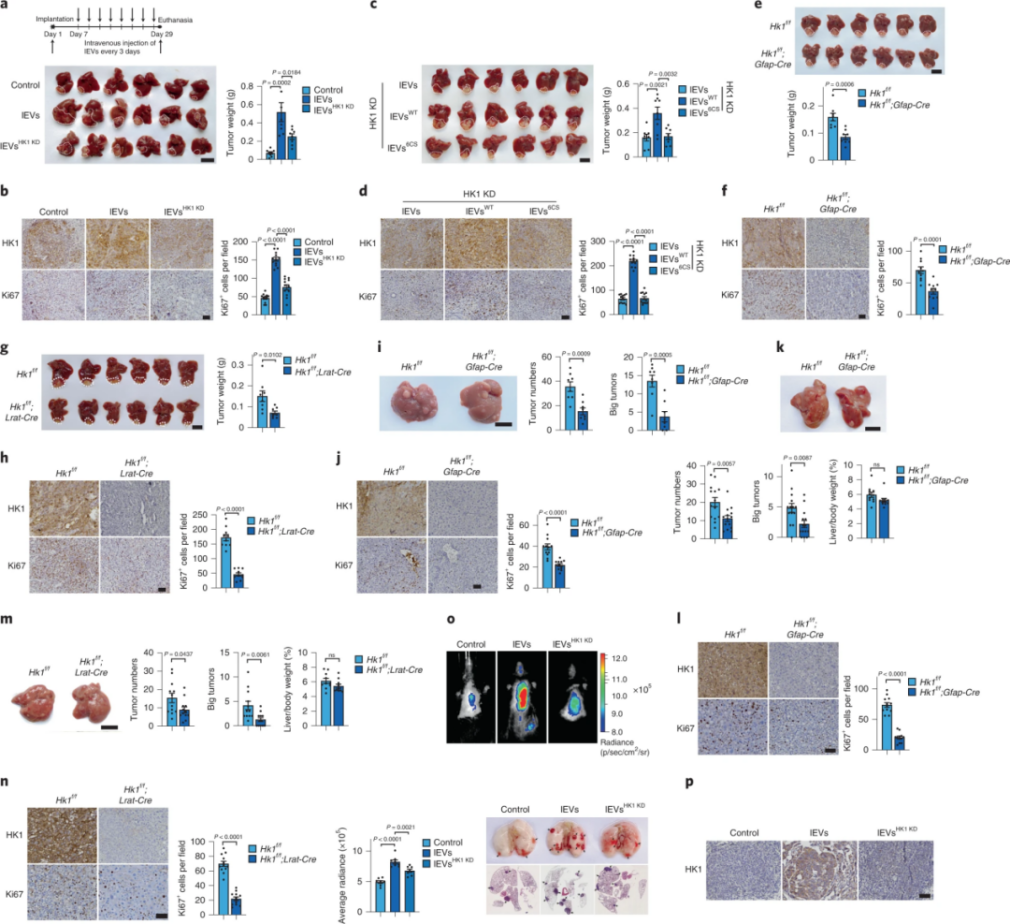
图4.不同条件诱导的小鼠模型证明了lEV HK1在促进HCC进展中的作用
5、Nur77抑制HSC分泌lEV HK1以抑制肝癌的发展进程
据报道,孤核受体Nur77可抑制TGF-β诱导的纤维化。研究者通过将Nur77转染到LX-2细胞中证实了这一点。Nur77能够上调ABHD17B表达,敲除Nur77或敲除ABHD17B后,lEV HK1的分泌增多且棕榈酰化增强。表明Nur77抑制lEV HK1棕榈酰化以阻碍 HK1的分泌。研究者利用不同蛋白激酶的抑制剂处理LX-2细胞,发现PI3K-Akt途径的抑制剂LY294002能阻断TGF-β诱导的Nur77的降解。此外,当HK1在肝星状细胞中被特异性敲除时,Nur77的缺失不再影响肿瘤生长。表明Nur77通过抑制肝星状细胞分泌lEV HK1,从而抑制肝癌的发展进程。
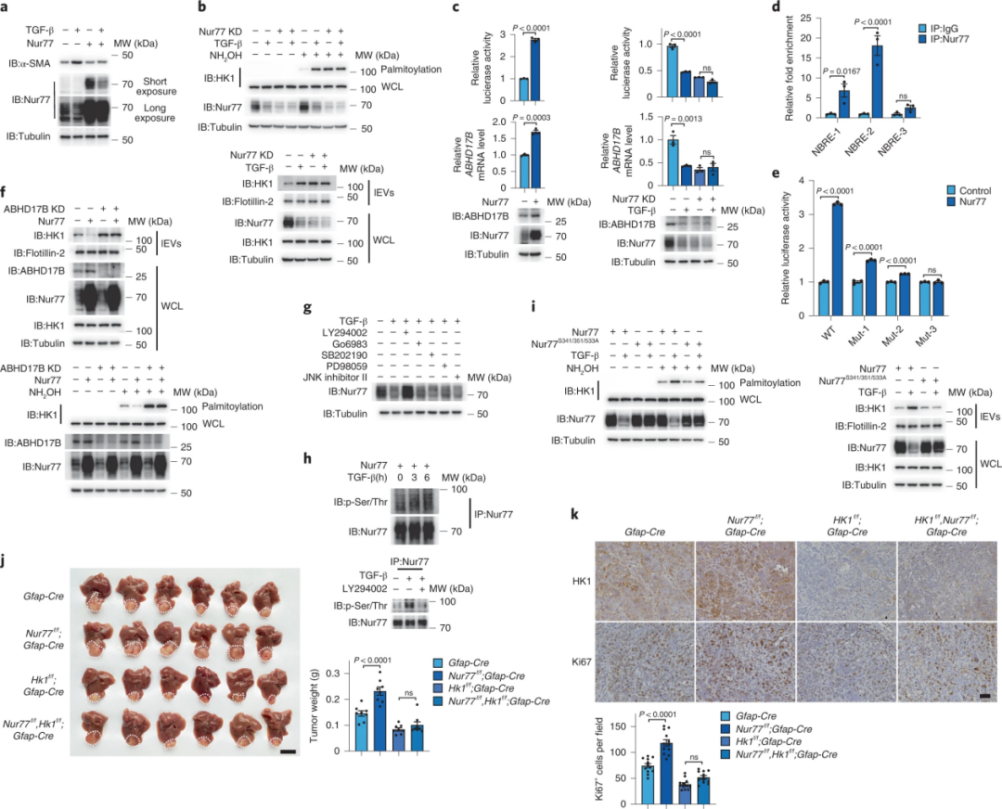
图5.Nur77抑制HSC分泌lEV HK1
6、小分子PDNPA靶向Nur77以抑制lEV HK1的分泌
研究者通过筛选发现小分子化合物PDNPA能与Nur77配体结合域结合,由此阻碍了Akt与Nur77的相互作用,并且显著修复TGF-β降低的Nur77蛋白水平,抑制HK1的外泌。此外PDNPA在基因和蛋白水平上恢复了ABHD17B的表达,从而阻止了TGF-β诱导的HK1棕榈酰化和分泌。在小鼠肝细胞癌模型中,PDNPA能够显著减少肿瘤数目及肿瘤组织中HK1和Ki67的表达。在肝星状细胞中特异性删除Nur77后,PDNPA作用被削弱。因此,PDNPA诱导的Nur77表达的升高通过抑制肝星状细胞分泌lEV HK1从而抑制肝癌的发展进程。
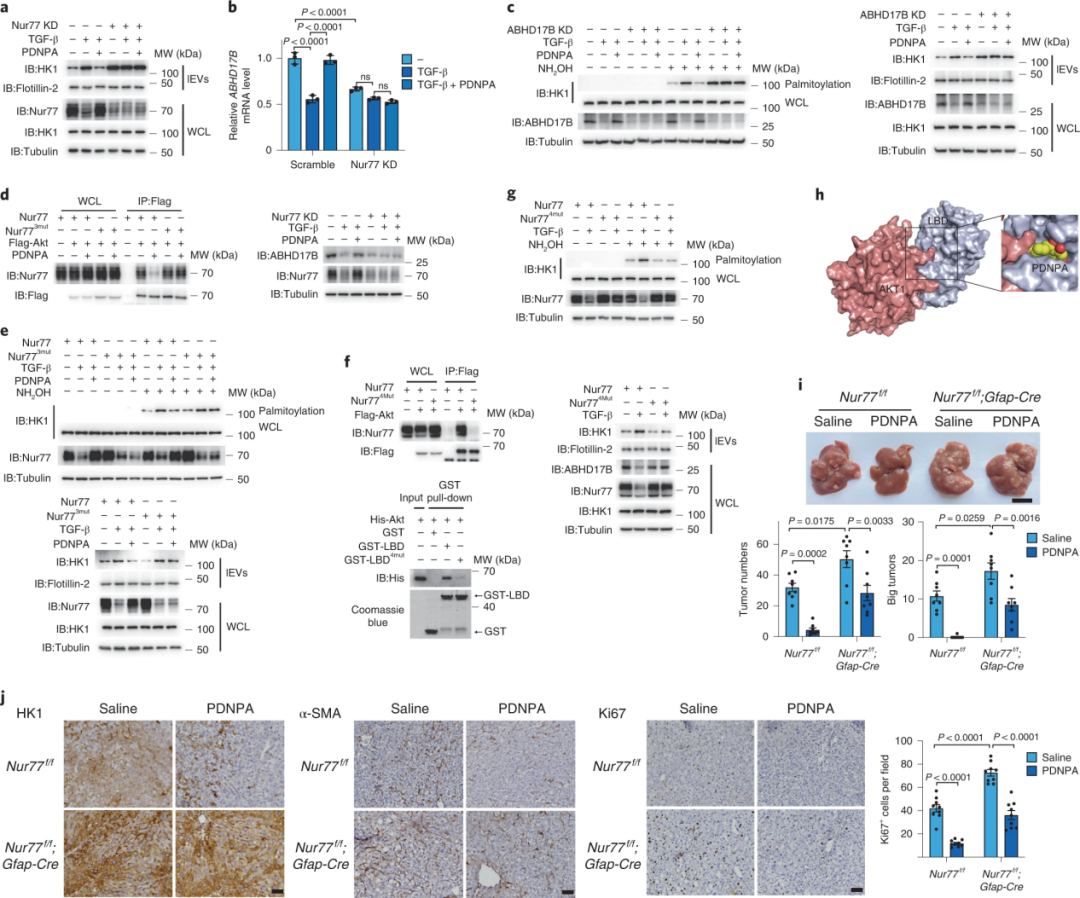
图6.PDNPA诱导Nur77的表达以抑制lEV HK1的分泌
结论
上述研究表明,在肝纤维化过程中,肝星状细胞中TGF-β能通过PI3K-Akt途径诱导Nur77降解,导致ABHD17B的表达受到抑制,因此增强了HK1的棕榈酰化,促进HK1转移到质膜并通过lEVs分泌。而肝星状细胞来源的lEV HK1能够被HCC细胞劫持来促进糖酵解重编程和肝癌的发展进程。此外,研究发现小分子化合物PDNPA靶向Nur77以抑制TGF-β诱导的HK1分泌,从而有效延缓肝癌发病。
补充知识:
肝星状细胞(Hepatic stellate cells,HSCs)主要参与肝脏纤维化,并且与肝细胞癌(HCC)关系密切[1-2]。大多数HCC病例是在严重的肝脏纤维化或肝硬化的情况下发生的。促纤维化细胞因子TGF-β在发育和组织稳态过程中调节着各种过程,在纤维化的肝脏中明显增加以激活肝星状细胞[3]。临床数据显示,活化的肝星状细胞与HCC患者的预后不佳有关,并以多种方式影响HCC的发展[4-5]。胞外囊泡(EVs)在肿瘤微环境的细胞间交流中发挥着关键作用,可作为早期HCC诊断的生物标志物[6-7]。研究EV介导的HCC细胞和肝星状细胞之间的相互作用有望进一步促进临床治疗。糖酵解重编程也是肝脏纤维化的一个重要特征[8]。Hexokinase(HK)是糖酵解的重要限速酶之一,对葡萄糖的利用至关重要。最近,HK1被认为可以促进肿瘤的代谢重编程[9],然而HK1在HCC进展中的功能尚不明确。
参考文献
[1]Duran, A. et al. p62/SQSTM1 by binding to vitamin D receptor inhibits hepatic stellate cell activity, fibrosis, and liver cancer. Cancer Cell 30, 595–609 (2016).
[2]Yoshimoto, S. et al. Obesity-induced gut microbial metabolite promotes liver cancer through senescence secretome. Nature 499, 97–101 (2013).
[3]Liu, X., Hu, H. & Yin, J. Q. Therapeutic strategies against TGF-β signaling pathway in hepatic fibrosis. Liver Int. 26, 8–22 (2006).
[4]Han, S. et al. Activated hepatic stellate cells promote hepatocellular carcinoma cell migration and invasion via the activation of FAK-MMP9 signaling. Oncol. Rep. 31, 641–648 (2014).
[5]Lin, N. et al. Activated hepatic stellate cells promote angiogenesis in hepatocellular carcinoma by secreting angiopoietin-1. J. Cell. Biochem. 121, 1441–1451 (2020).
[6]Ge, Y. et al. Hepatocellular carcinoma-derived exosomes in organotropic metastasis, recurrence and early diagnosis application. Cancer Lett. 477, 41–48 (2020).
[7]Li, X. et al. The significance of exosomes in the development and treatment of hepatocellular carcinoma. Mol. Cancer 19, 1 (2020).
[8]Mejias, M. et al. CPEB4 increases expression of PFKFB3 to induce glycolysis and activate mouse and human hepatic stellate cells, promoting liver fibrosis. Gastroenterology 159, 273–288 (2020).
[9]Amendola, C. R. et al. KRAS4A directly regulates hexokinase 1. Nature 576, 482–486 (2019).
声明:以上内容为本网站转自其它媒体,相关信息仅为传递更多企业信息之目的,不代表本网观点,亦不代表本网站赞同其观点或证实其内容的真实性。投资有风险,需谨慎。
- 启辰VX6实车曝光,预计售价10万-20万元
- 岚图汽车入选“2023企业ESG杰出创新案例”
- 长安汽车与蔚来开展换电业务合作
- 研究人员设计碳纳米管海绵阴极有助于释放锌离子混合电容
- 2023年倒计时,长安启源1212购车盛典提前享,至
- 极狐阿尔法T5预售15.58万起同级唯一800V超充
- 10月13—18日赶紧来武汉国博中心看看!
- 岚图汽车9月交付量破5千,24款梦想家将开启交付
- 能耗卷王星光驾到,五菱用自己的方式重新定义A级家轿
- 限时特价10.88万起哪吒X是十万级纯电SUV新卷王
- “智美顶流”走向国际,阿维塔11惊艳亮相泰国车展
- 马自达CEO:除了特斯拉,其他品牌电动车都卖不动
- 银河E8细节曝光:能否威胁比亚迪汉的地位?
- 据说宋L预售价25万左右,大家觉得还香不
- 超值大6座MPV!仅7.69万起,配2.0L油混,要
Copyright (C) 1999- www.bandworld.cn, All Rights Reserved
版权所有 环球快报网 网站地图 备案号:皖ICP备2022015281号 邮箱:bgm1231@sina.com



